Jak nazwać związki chemiczne
Autor:
Laura McKinney
Data Utworzenia:
2 Kwiecień 2021
Data Aktualizacji:
26 Czerwiec 2024

Zawartość
- etapy
- Metoda 1 Nomenklatura związków jonowych
- Metoda 2 Nomenklatura związków wieloatomowych
- Metoda 3 Nazewnictwo związków kowalencyjnych
Sukces w dziedzinie chemii wymaga wiedzy, jak nazwać podstawowe związki chemiczne. Ten przewodnik zawiera podstawowe zasady dotyczące procesu nazywania związków chemicznych i sposobu przypisywania nazw nieznanym Ci związkom.
etapy
Metoda 1 Nomenklatura związków jonowych
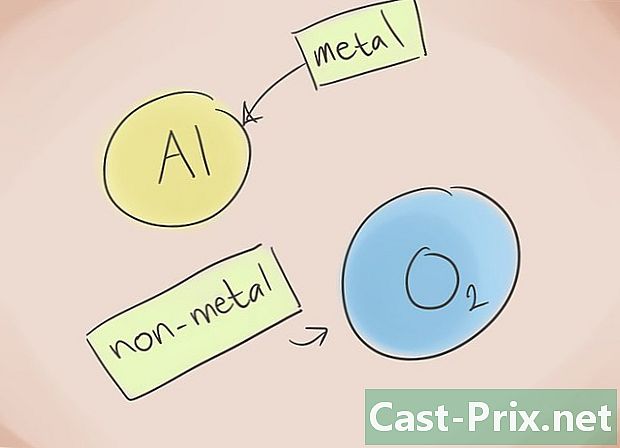
- Co to jest związek jonowy? Związki jonowe składają się z metalu i niemetalu. Następnie zapoznaj się z układem okresowym pierwiastków, aby dowiedzieć się, które kategorie należą do elementów obecnych w związku.
-

Utwórz nazwę. Nic nie jest łatwiejsze niż nazywanie związku jonowego dwóch pierwiastków. Rzeczywiście, pierwsza część nazwy związku odpowiada nazwie elementu niemetalicznego noszącego przyrostek „ure”, podczas gdy druga odpowiada nazwie elementu metalowego. Istnieją wyjątki: tlenek, fosforek, azotek, siarczek.- Przykład: Al2O3, al2 = Aluminium; O3 = Tlen. Tak więc nazwą tego związku będzie „tlenek glinu”.
-
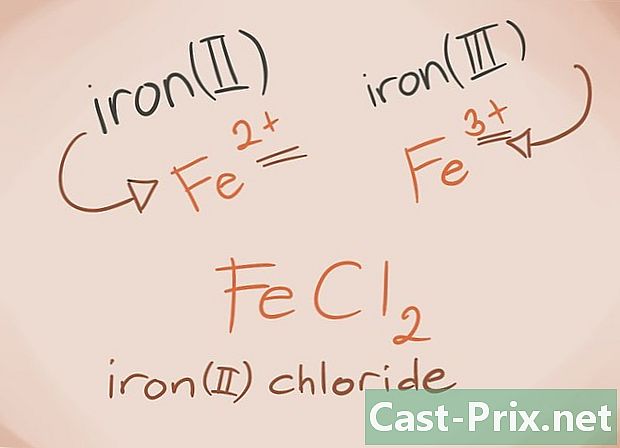
Poznaj metale przejściowe Metale przejściowe to te znajdujące się w blokach D i F układu okresowego. W imieniu związku ładunek tych metali jest zapisany cyframi rzymskimi. Wynika to z faktu, że metale przejściowe mogą przenosić większe obciążenia i tworzyć więcej związków.- Przykład: FeCl2 i FeCl3, Fe = żelazo; cl2 = -2 chlorek; cl3 = Chlorek -3. Jak nazwy, będzie chlorek żelaza (II) i chlorek żelaza (III).
Metoda 2 Nomenklatura związków wieloatomowych
-

Musisz zrozumieć, czym jest związek wieloatomowy. Związki wieloatomowe to związki utworzone przez grupę powiązanych ze sobą grup danych; cała grupa niosąca ładunek jest dodatnia lub ujemna. Istnieją zatem trzy podstawowe działania, które można wywierać na związki wieloatomowe:- Możesz dodać wodór do pierwszej części związku. Słowo „wodór” rzeczywiście dodano na początku nazwy związku. Spowoduje to zmniejszenie wartości ładunku ujemnego o jeden. Na przykład CO „węglanowy”3 staje się HCO „wodorowęglanem”3.

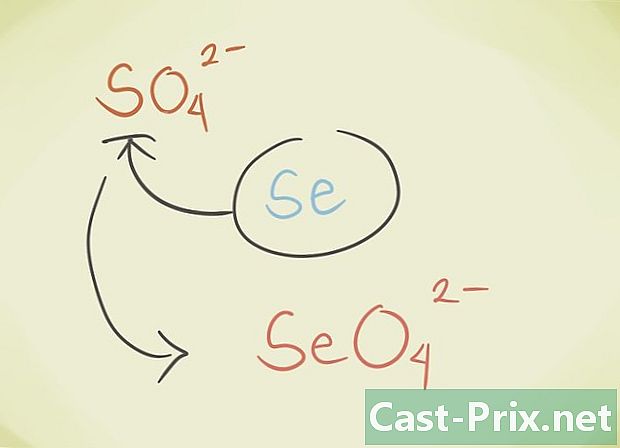
- Możesz również usunąć tlen ze związku. Obciążenie nie jest zmieniane, ale przyrostek „-ate” związku jest zmieniany na „-ique”. Na przykład przekształcenie: NIE3 w NIE2 przechodzimy od azotanu do azotanu. "

- Można zastąpić centralny latom związku innym atomem należącym do tej samej grupy okresowej. Na przykład siarczan SO4 można zastąpić Selenate SeO4.
- Możesz dodać wodór do pierwszej części związku. Słowo „wodór” rzeczywiście dodano na początku nazwy związku. Spowoduje to zmniejszenie wartości ładunku ujemnego o jeden. Na przykład CO „węglanowy”3 staje się HCO „wodorowęglanem”3.
-

Zapamiętaj najczęstsze grupy dionowe. Poniższe grupy są używane do tworzenia większości związków wieloatomowych. Zgodnie z rosnącą kolejnością ich ujemnego ładunku mamy:- jony wodorotlenkowe: OH
- jony azotanowe: NIE3
- Jony wodorowęglowe: HCO3
- jony nadmanganianowe: MnO4
- jony węglanowe: CO3
- jony chromianowe: CrO4
- jony dichromianowe: Cr2O7
- jony siarczanowe: SO4
- jony siarczynowe: SO3
- jony tiosiarczanowe: S2O3
- Jony fosforanowe: PO4
- jony amonowe: NH4
- Utwórz złożone nazwy z powyższej listy. Utwórz powiązanie nazwy z dowolnym elementem związanym z grupą. Jeśli element zostanie umieszczony przed grupą jonową, wówczas nazwa elementu zostanie po prostu dodana na początku nazwy związku.
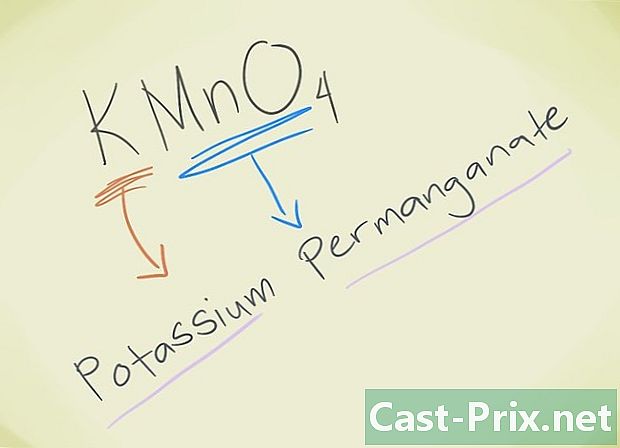
- Przykład: KMnO4, Musisz być w stanie poznać tego lwa MnO4 odpowiada nadmanganianowi lwa. K odnosi się do potasu. Twój związek będzie więc nazywał się nadmanganianem potasu.
- Przykład: NaOH. Prawdopodobnie zrozumiesz tutaj, że jest to OHOH. Na oznacza sód, więc związek będzie nazywany wodorotlenkiem sodu.

- Przykład: KMnO4, Musisz być w stanie poznać tego lwa MnO4 odpowiada nadmanganianowi lwa. K odnosi się do potasu. Twój związek będzie więc nazywał się nadmanganianem potasu.
Metoda 3 Nazewnictwo związków kowalencyjnych
-
Co to jest związek kowalencyjny? Związki kowalencyjne powstają w wyniku połączenia co najmniej dwóch pierwiastków niemetalicznych. Nazwa związku zależy od liczby danych, które go tworzą. Grecki przedrostek obok tej nazwy wskazuje liczbę cząsteczek obecnych w związku. -
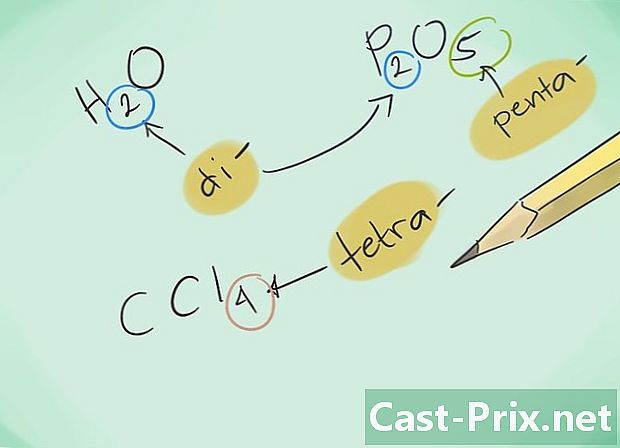
Zapoznaj się z prefiksami. Zapamiętaj następujące przedrostki dla związków o 1 do 8 atomach:- 1 atom - „Mono-”
- 2 atomy - „Di-”
- 3 atomy - „Tri-”
- 4 atomy - „Tetra-”
- 5 atomów - „Penta-”
- 6 atomów - „Heksa-”
- 7 atomów - „Hepta-”
- 8 atomów - „Octa-”
- Następnie nazwij związki. Nazwij powstały związek, używając odpowiednich prefiksów. Przedrostki należy szczepić na każdym z elementów tworzących związek z kilkoma atomami.
- Przykład: CO powróci do tlenku węgla podczas gdy CO2 wyznaczy dwutlenek węgla.
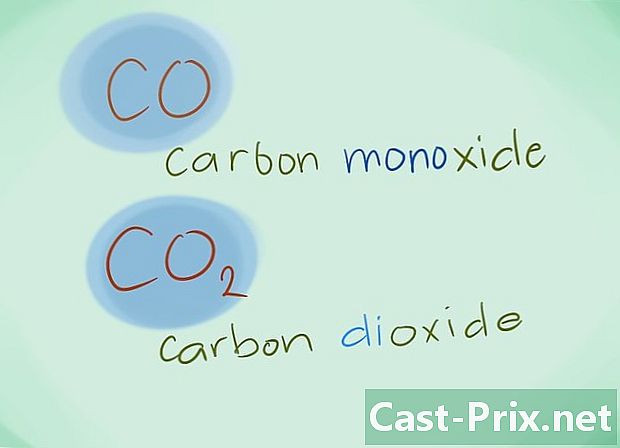
- Przykład: N.2S3 odpowiadałoby podtlenkiem trójsiarczku.

- W większości przypadków prefiks „mono” można pominąć; to, bardziej niż jakikolwiek brak prefiksu, powoduje, że należy użyć tego drugiego. Ten przedrostek jest nadal stosowany w przypadku tlenku węgla, biorąc pod uwagę fakt, że to zastosowanie sięga pierwszych migotańców chemii.
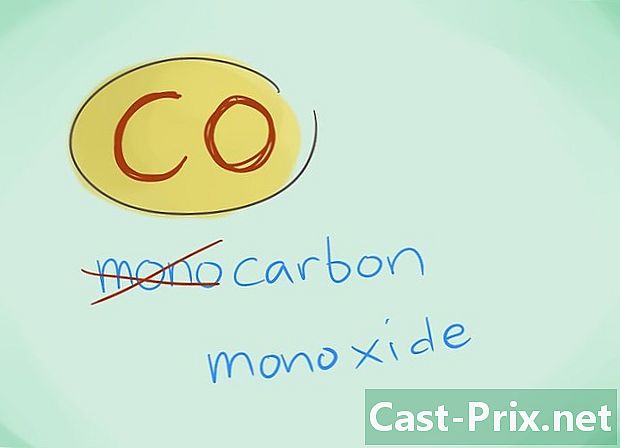
- Przykład: CO powróci do tlenku węgla podczas gdy CO2 wyznaczy dwutlenek węgla.
- Oczywiście podejrzewasz, że do wszystkich tych zasad stosuje się kilka wyjątków; przytrzymaj na przykład tę formułę, CaCl2Oczekuje się, że będzie to nazywane „dichlorek wapnia”, który jest NIE. Twój związek po prostu zachowa nazwę chlorek wapnia.
- Należy również zauważyć, że wszystko to nie dotyczy chemii organicznej.
- Szczegółowe zasady tutaj są przeznaczone dla początkujących odbiorców w chemii i nauce. Gdy przechodzisz przez zaawansowany etap chemii, istnieją bardzo różne zasady, takie jak zasady dotyczące zmiennej wartościowości.